荧光染料基本知识
通过染料的荧光,研究者可以从复杂的生物体中选择性观察某个特定的细胞器官或者蛋白,比如观察活细胞中的线粒体结构,具有很高的灵敏度和选择性。荧光染料是生物医学实验中非常常用的工具,了解它们的基本原理对灵活使用这个工具非常重要,在这个小节中,多荧生物主要面向入门者介绍一下荧光染料的基础知识。
荧光染料发光原理
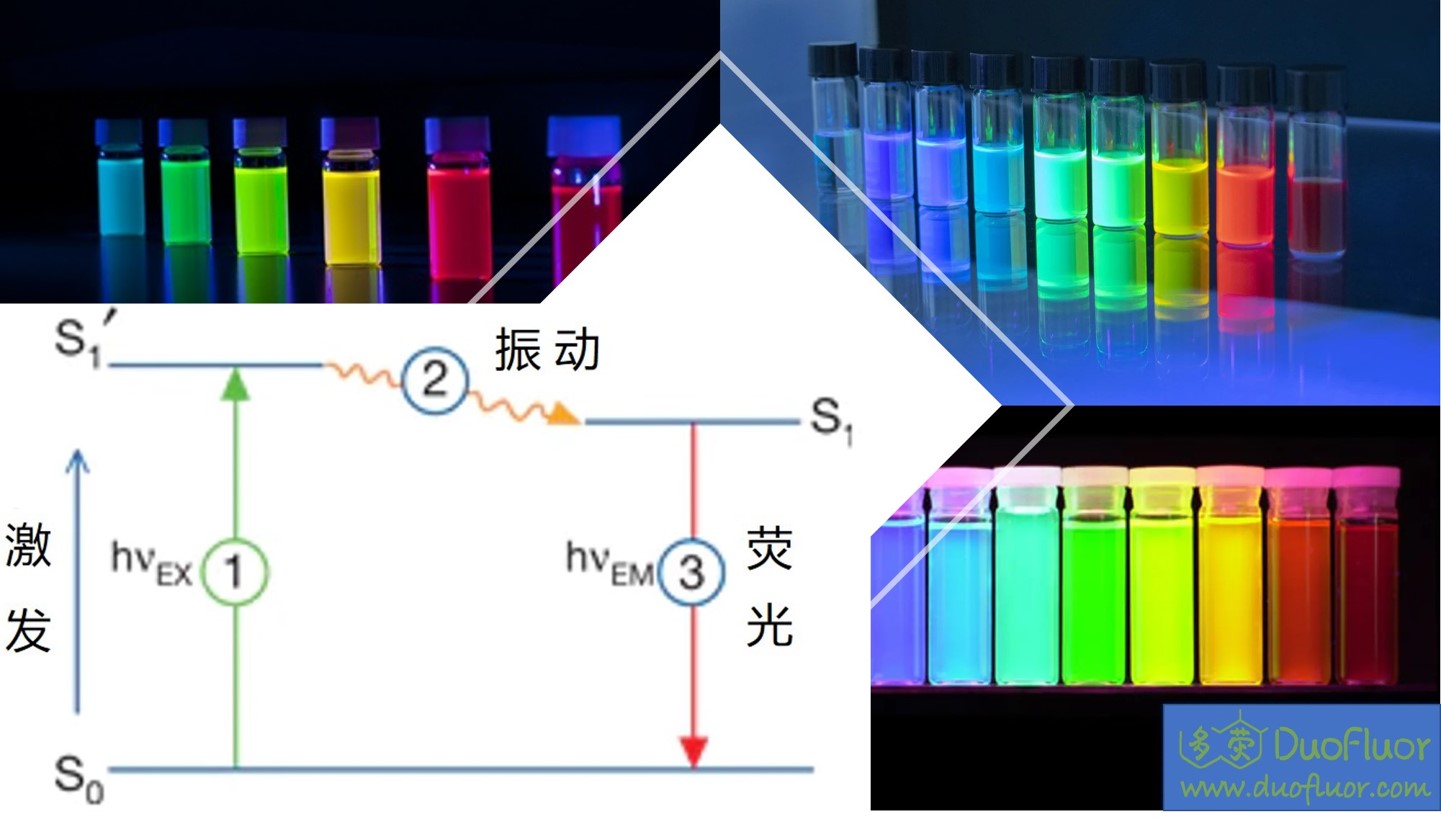
荧光染料大部分都是带多个芳香环的有机分子,颜色较深,因此可以吸收特定波长的光,这个光即染料的激发光。吸收激发光后,染料分子的分子能量增加,处于激发态(S1’)。激发态能级高,并不是一个稳定状态,因此有机分子一般通过化学键旋转或者震动释放能量回到基态(S0),但是染料分子结构特殊,在通过机械运动释放部分能量到达某个特定能级(S1)后,直接跳到基态,同时将剩余的能量以光子的方式释放出来,即发出荧光。由于荧光光子在发射前已经通过分子运动损失了部分能量,所以荧光的光子能量比激发光低,最终表现为波长比激发光长(波长越短能量越高),即光谱红移。比如FITC的激发光最高峰(Em)为494nm,而它的发射光最高峰(Ex)为520nm。
染料激发和荧光发射是可以不断循环的,只要染料的荧光核化学结构在这个过程中不被破坏(即光漂白,荧光核的化学结构在处于激发态高能级时偶尔引起化学键断裂或者化学反应,使染料无法再发荧光),染料可以不断的发射荧光。一个染料分子可以发射几万次、几十万次荧光,这个也是荧光染料显影灵敏性高的基础。
染料光谱图
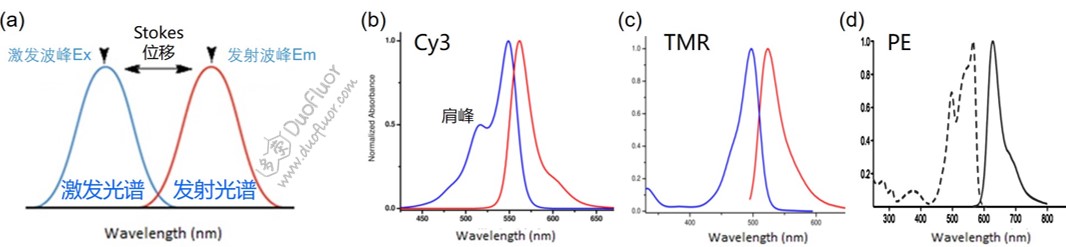
在我们接触染料时,第一个看的的资料就是染料的光谱图。光谱图有两个光谱曲线,左边是激发光谱,这个谱线几乎等同于染料的吸收光谱图(可见光区),右边是发射光谱,即荧光光谱。激发光谱中的最高吸收峰(Excitation maiximum)简称Ex,而发射光谱的最高峰(Emission maximum)则简称Em,这是荧光染料非常重要的两个参数。从谱形来看,激发光谱和发射光谱有些是对称的,Cy3系列的染料激发峰还有一个肩峰,此外很多时候激发和发射谱图还有部分重叠区域。另外,我们看到的谱图往往显示激发峰高和发射峰高是一样的,这是为了让读者更好的比较两个波形,但是实际情况是激发峰的强度/峰高要比发射峰的高,因为染料量子产率一般低于100%,也就是说当激发光照射时,一部分染料分子发出来荧光,总有另一部分染料分子没有发出荧光。多荧生物将在下面介绍荧光染料的几个重要概念。
Ex/Em
激发峰和发射峰。染料可以被一定宽度波长范围内的光激发,染料激发时最高吸收峰波长就是激发峰,同样发出的荧光也是一个宽泛范围的荧光,最强的荧光波长即是发射峰。染料用激发峰波长的光照射时荧光最强,同样,在发射峰左右检测光信号时,最明亮最灵敏。每种染料都有特定的Ex/Em值,但是在不同溶剂(水溶剂 vs 有机溶剂)中,测得的Ex/Em值可能会不一样,另外不同仪器上测量可能会有轻微偏差。我们列出的Ex/Em值都是以生物实验条件,一般为PBS或者TBS中测得。
Stokes位移
英文为Stokes shift。Stokes位移是指吸收光谱波峰(Ex)和荧光发射光谱波峰(Em)之间的峰位差值。荧光光谱与激发光谱相比,将向能量较低的方向偏移(红移),Stokes位移反应的实际上是两个光子能量的差值,能量的差值主要是由于化学键旋转振动的热损耗。不同染料的Stokes位移差别很大,比如BODIPY染料Stokes位移只有10nm左右,Cy系列染料有20-30nm,有个染料比如GelRed可以达到200-300nm之多。染料Stokes位移的大小对我们荧光实验是激发光波长和发射光波长选择会有一些影响,如果Stoke位移比较小(比如BODIPY染料),我们不能使用Ex/Em波长进行激发和检测,避免它们太近发生干扰。
消光系数
英文为Extinction coefficient,常用ε表示。中文有时候也叫摩尔吸收光系数,指的是当特定波长的单色光(荧光染料一般用最大激发波长Ex)通过1cm光程的比色皿溶液时,1 mol/L浓度的染料的吸光度值。任何染料的消光系数都是它的固定参数,可用来计算染料的浓度。比如,我们将某个未知浓度的染料标记样品测定Ex波长下的吸收值A后,可用公式 conc = A / ε 计算得到准确的染料浓度,这是一个标准的、很准确的浓度测定方法。当然,在测定吸收值A时,你需要将样品稀释到合适的程度,不要让读数超过分光光度计的测量范围。
消光系数和染料的荧光亮度有关。染料的荧光亮度与消光系数和量子产率都成正比关系。这个很容易理解,消光系数其实反映的是染料在最大激发波长Ex下对光的吸收能力,消光系数越高,吸收能力越强,染料获得能量越高,发射的荧光光子越多,荧光越亮。我们可以看一下下面几种染料的消光系数。不同染料之间消光系数差距很大。
* 以上数据仅做参考,不同来源的数据差距较大,这与测量时的溶剂、仪器和观测条件有关。
量子产率
英文为Fluorescence quantum yield (QY),常用Φ表示。染料分子吸收激发光能量到达激发态,通过机械振动释放部分能量到达S1态,然后发射一个荧光光子跳跃到基态,完成一个循环,但是有一部分染料分子在S1态时并不发光跳跃到基态,而是继续化学键旋转或者振动的方式释放能量,直到到达稳定的基态。因此,我们可以看到,荧光染料吸收光子激发后不会释放等数量的荧光光子。荧光量子产率就是指激发态染料分子中通过发射荧光而回到基态的分子占全部激发态分子的分数。量子产率最高为1,即每个激发态染料分子都会发一个荧光光子。染料分子的量子产率差别很大,比如荧光素的量子产率可达0.95,而Cy5的量子产率才0.2,部分近红外染料的量子产率更是低至 <0.1。大部分荧光染料的量子产率在0.3-0.6之间,但是实际的产率会因为荧光淬灭等原因低一些。另外,量子产率也和溶剂种类,pH等多种因素有关,比如荧光素在乙醇中的量子产率为0.79 cm-1M-1,而在0.1N NaOH溶液中时为0.95 cm-1M-1。量子产率不同公司给出的数据差异较大(比如Cy3的量子产率数据,有的为0.04,有的为0.31,差别达8倍之多),主要就是他们测量的溶剂条件不一样,很多数据来源在给出量子产率数据时没有同时标出测量条件,因此网络上的很多量子产率数据已经失去了参考意义,赛默飞公司官网上已经下架了各种染料的量子产率数据,目的就是避免混淆读者。我们公司提供的染料量子产率也仅仅作为参考,不应该作为评价染料性能的直接标准。
荧光亮度
英文为Fluorescence brightness。荧光染料的初始亮度由两个因素决定:消光系数(ε)和量子产率(Φ)。ε是指染料分子吸收激发光的能力有多强,而Φ是指将这些吸收的激发光能力转化为荧光的效率有多高。荧光染料的初始亮度可以用这个公式表示:Brightness = Extinction Coefficient (ε) x Fluorescence Quantum Yield (Φ)。
- PE = 1,960,000 cm-1M-1 x 0.84 = 1,646,400
- APC = 700,000 cm-1M-1 x 0.68 = 476,000
- Cy5 = 250,000 cm-1M-1 x 0.20 = 50,000
我们可以看到PE比APC明亮,APC比Cy5明亮。在这里,PE和APC是蛋白质类荧光染料,Cy5是小分子类荧光染料。另外我们需要注意到一点,所有这些亮度计算的都是初始亮度,就是染料刚刚被照射时的亮度,随着激发光照射的时间延长,染料会慢慢发生光漂泊现象(Photo bleaching)失去发荧光能力,因此在使用过程中,荧光信号会越来越弱。这个现象在荧光素,FITC等特别容易光漂泊的染料中非常明显。显微镜下,荧光素标记的样品绿色荧光会很快越来越弱,往往半分钟就非常暗淡了。荧光染料可以通过化学结构改造提高发光的稳定性,比如多荧生物提供的AF488等染料比荧光素稳定性高很多。
另外,我们肉眼观测、感觉到的荧光亮度还以荧光颜色有关,一般绿色和红色肉眼会感觉更明亮一些,对于CCD相机,主要检测光子流量,不会有这些差别。
荧光淬灭
英文为Fluorescence quenching。荧光猝灭是指荧光染料由于分子聚集,或者它们之间距离过近,互相干扰,而使发出的荧光信号变弱这一现象。荧光淬灭是一个可逆的过程,就是说如果将分子之间距离拉大,它们的荧光又会变强。这一点是它和荧光漂白的不同,荧光漂白是一个不可逆的过程,染料分子漂白后,分子结构已经被破坏,分子无法再发出荧光。荧光猝灭主要出现在这些情况下,比如染料分子不溶,或者染料分子浓度过高,或者染料分子标记到大分子表面的密度过大。
在大分子的荧光染料标记实验时需要考虑荧光淬灭现象。标记时需要控制大分子/染料的比例,不要过度的标记,大分子表面标记过多染料会使染料分子之间的距离过近,从而引发荧光淬灭,最后的过标记产物荧光反而不强。另外,需要注意的是荧光淬灭并不是荧光信号没有了,而是比预想的低,所以淬灭条件下的染料分子仍然可以发出荧光,只是比较弱而已。利用荧光淬灭现象,可以开发很多荧光探针。比如下图所示探针检查到目标产物后发生形变,两头的染料分子距离变大,淬灭现象消失,荧光增强。
光漂白
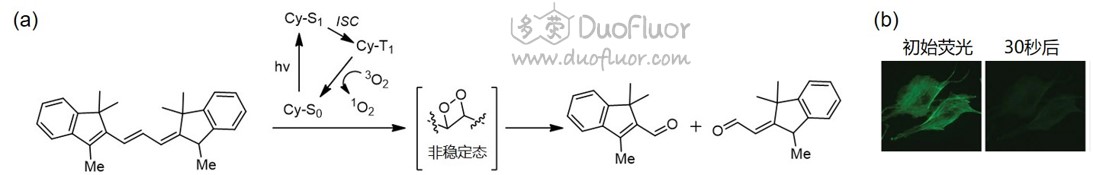
英文为photo bleaching。荧光漂白表现为染料荧光母核的化学结构破坏。在激发态高能量下,染料母核化学键部分断裂,使母核发荧光的结构破坏,无法再发出荧光。荧光漂白是一种普遍现象,几乎所有的染料都会有漂白现象,但是由于化学结构和发光原理的差别,荧光漂白的难易程度差别很大,比如荧光素(包括FITC)很容易光漂白,而结构不同的AF488比较稳定,可以照射很长时间,荧光强度变化不大,而Quantum dots (QDs) 由于发光原理不同,几乎很难光漂白。由于荧光漂白对荧光实验的干扰性很大,特别是那些间歇性拍摄实验,拍摄完成后应立即将激发光源从样品上面移除,避免过度照射。同时,荧光漂白的难易程度也是检验不同染料质量的重要标志,高级的、价格高的染料一般经过特意改造,具有较高的荧光亮度和较强的漂白耐受度,适用于重要的实验。
背景荧光
背景荧光,是荧光实验时的噪声,指在图像中观察到、但又不希望它出现的荧光信号。背景荧光有许多来源,在这里主要讨论来自样品的背景荧光。背景荧光可能来自于样品没有洗脱掉非特异性吸附的染料或者干扰性物质(这个情况比较好处理,只需要改善洗涤条件就可以了),更多的情况是来自于样品自带的荧光。所有的物质在强光照射下都会发出非常微弱的荧光,因此在我们所需要观测的样品荧光信号比较微弱的情况下,背景荧光会非常明显。一般情况下,蓝光或者绿光的背景荧光比较明显,随着荧光波长红移,生物样品的背景荧光越来越弱,所以,对于背景荧光干扰大的样品,选择红色荧光或者近红外荧光染料会更好一些。另外,也可利用特殊试剂处理生物样品,降低背景荧光。



 17771470352
17771470352
 Duofluor
Duofluor 





